加齢指標タンパク質30はL-アスコルビン酸生合成におけるグルコノラクトナーゼであり、ノックアウトマウスは壊血病になるSenescence marker protein 30 functions as gluconolactonase in L-ascorbic acid biosynthesis, and its knockout mice are prone to scurvy
論文サマリー
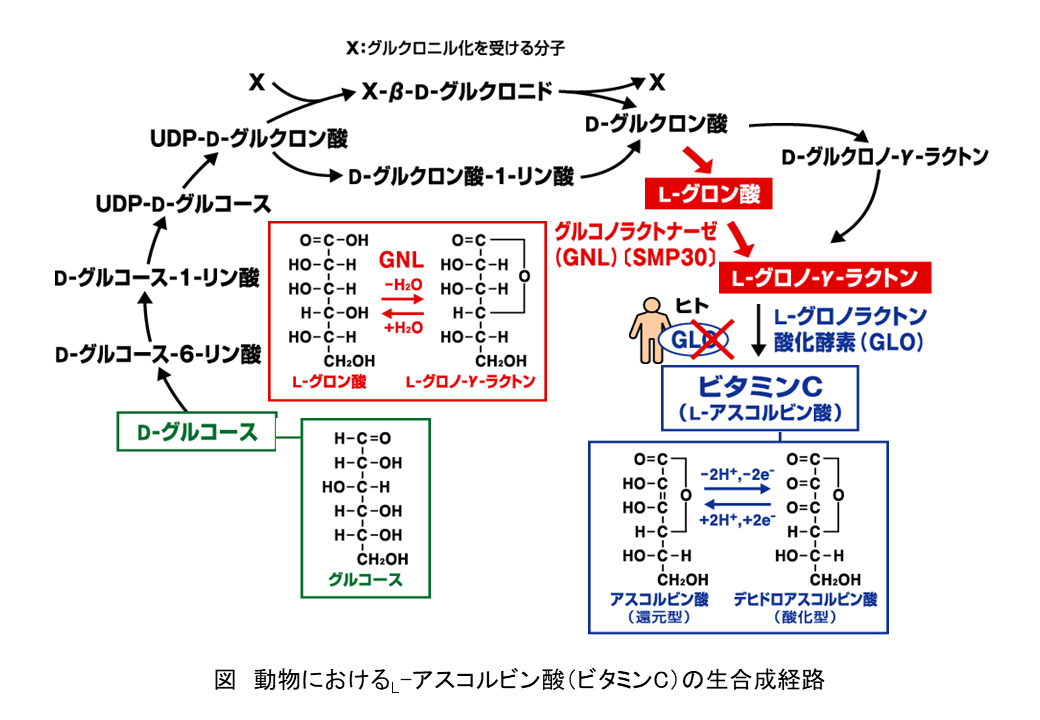
加齢指標タンパク質30(senescence marker protein 30; SMP30)は、雌雄ともに加齢に伴い減少するタンパク質として同定したが、SMP30の機能は長い間分からなかった。しかし、BLAST検索の結果、ラットSMP30のアミノ酸配列は、細菌類のグルコノラクトナーゼ(gluconolactonase; GNL)と相同性を示すことを見いだした。ラット肝臓から精製したSMP30は、Zn2+やMn2+存在下において、D体とL体のグルコノ-δ-ラクトンやグロノ-γ-ラクトン、ガラクトノ-γ-ラクトンといったアルドノラクトンに対するラクトナーゼ活性を示した。また、ラットSMP30組換えタンパク質もGNL活性を示したほか、ラット肝臓から精製したGNLのアミノ酸配列はSMP30と一致した。さらに、野生型マウスの肝臓ではGNL活性が認められたが、SMP30ノックアウト(KO)マウスにおいては全く認められなかった。以上の結果から、SMP30は肝臓で唯一のGNLであることが示された。
哺乳類におけるGNLは、L-アスコルビン酸(L-ascorbic acid; AA, vitamin C; VC)生合成経路の最後から2番目の段階において、L-グロン酸からL-グロノ-γ-ラクトンを生成する酵素である。SMP30はこの酵素反応において必須の役割を持つかどうかを、SMP30 KOマウスを用いた栄養学的実験により確かめた。30日齢で離乳した野生型マウスとSMP30 KOマウスは、オートクレーブした通常飼料(AA含量:55 mg以下/kg)を10日間与えた後、AA欠乏飼料を与えて飼育した。野生型マウスは体重が増加したが、SMP30 KOマウスはAA欠乏56日以降、体重が減少し始めた。AA欠乏59日後のSMP30 KOマウスは、野生型マウスに比べて骨密度が低く、大腿骨の骨折や念珠(肋骨と肋軟骨の間からの出血)といった壊血病の典型的な症状が認められた。また、SMP30 KOマウスは、AA欠乏37日後に1匹、106-135日後までに全個体が死亡した。死亡時におけるSMP30 KOマウスの肝臓および腎臓のAA量は、野生型マウスの1.6%未満であった。従って、SMP30 KOマウスはAAを体内で合成できずにAA欠乏症状を呈することから、SMP30はAA生合成経路において必須のGNLであることが明らかとなった(図)。
D-グルクロン酸からL-グロノ-γ-ラクトンに至る経路には、SMP30/GNLが関わる経路とは別に、D-グルクロノ-γ-ラクトンを経る別経路の存在が議論されていた。別経路の有無に結論を出すため、離乳後からオートクレーブした通常飼料を60日間与えたSMP30 KOマウスにD-グルクロノ-γ-ラクトンを毎日腹腔内投与した結果、尿中への1日あたりのAA排泄量は経時的に増加した。この結果は、D-グルクロノ-γ-ラクトンが関わるAA生合成の別経路が生体内に存在することを示したが、AA生合成量に対する寄与率はかなり低いと考えられる。
グラフィックサマリー
解説者コメント
本研究により、動物におけるAA生合成経路の一部を明らかにすることができました。AAを体内で作れないSMP30 KOマウスは、これまで多くの共同研究者の方々に活用されており、生体内におけるAAの多様な役割解明に役立っています。

